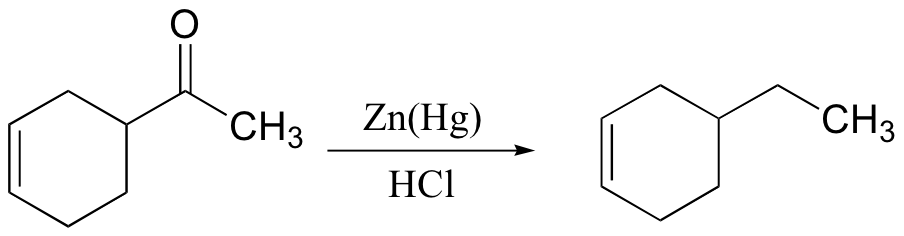
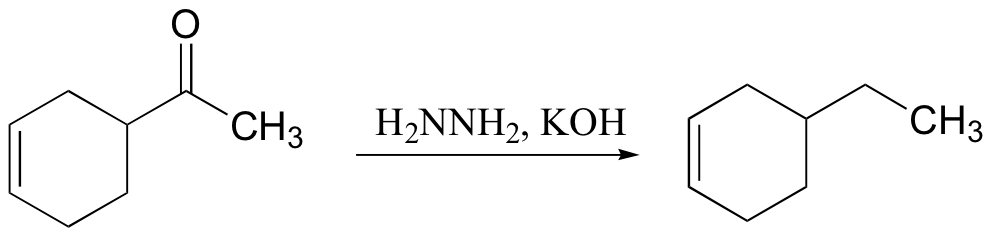DERIVAT ASAM KARBOKSILAT
Jika gugus fungsi yang sama ini terikat pada gugus asil (RCO-), sifatnya berubah secara substansial, dan ditetapkan sebagai turunan asam karboksilat . Asam karboksilat memiliki gugus hidroksil yang terikat pada gugus asil, dan turunan fungsionalnya dibuat dengan mengganti gugus hidroksil dengan substituen, seperti halo, alkoksil, amino dan asiloksi. Kelompok-kelompok senyawa yang termasuk turunan asam karboksilat adalah: Asam karboksilat,ester,Amida,Asil halida,anhidrida asam
Beberapa turunan asam karboksilat beserta sifat fisik nya adalah sebagai berikut :
Sifat Fisik Beberapa Turunan Asam Karboksilat
Rumus | Nama IUPAC | Berat molekul | Titik didih | Kelarutan air |
|---|---|---|---|---|
| CH 3 (CH 2 ) 2 CO 2 H. | asam butanoat | 88 | 164 ºC | sangat larut |
| CH 3 (CH 2 ) 2 CONH 2 | butanamide | 87 | 216-220 ºC | larut |
| CH 3 CH 2 CONHCH 3 | N-metilpropanamida | 87 | 205 -210 ºC | larut |
| CH 3 CON (CH 3 ) 2 | N, N-dimetiletanamida | 87 | 166 ºC | sangat larut |
| HCON (CH 3 ) CH 2 CH 3 | N-etil, N-metilmetanamida | 87 | 170-180 ºC | sangat larut |
| CH 3 (CH 2 ) 3 CN | pentanenitril | 83 | 141 ºC | sedikit larut |
| CH 3 CO 2 CHO | anhidrida metanoat etanoat | 88 | 105-112 ºC | bereaksi dengan air |
| CH 3 CH 2 CO 2 CH 3 | metil propanoat | 88 | 80 ºC | sedikit larut |
| CH 3 CO 2 C 2 H 5 | etil etanoat | 88 | 77 ºC | agak larut |
| CH 3 CH 2 COCl | propanoil klorida | 92.5 | 80 ºC | bereaksi dengan air |
| CH 3 (CH 2 ) 3 CHO | pentanal | 86 | 103 ºC | sedikit larut |
| CH 3 (CH 2 ) 2 COCH 3 | 2-pentanone | 86 | 102 ºC | sedikit lar |
- Mula-mula terjadi pembentukan intermediat tetrahedral melalui reaksi adisi
- Kemudian terjadi eliminasi salah satu dari dua substituen pada atom C karbonil, maka secara keseluruhan terjadi reaksi substitusi nukleofilik.
faktor yang mempengaruhi kereaktifan turunan asam karboksilat adalah:
Faktor Sterik
Derivat/turunan asam karboksilat yang tidak mempunyai hambatan sterik/ruang akan lebih mudah mengalami serangan nukleofilik daripada yang mempunyai hambatan sterik, contoh: asetil klorida lebih reaktif daripada 2,2-dimetil propanoil klorida. Urutan kereaktifan senyawa karbonil adalah Amida, ester,anhidra asam dan alkanoil kloridaGugus alkil (R) memiliki ukuran yang lebih besar dibanding atom hidrogen. Akibat gugus alkil yang besar, membuat nukleofil yang akan masuk menyerang gugus karbonil terhalang. Halangan inilah yang dimaksud dengan halangan sterik. Semakin besar ukuran atom yang terikat pada gugus karbonil, semakin sulit pula nukleofil menyerang gugus karbonil. Berarti halangan steriknya juga semakin besar. Sehingga reaksi akan sulit terjadi (berlangsung lambat).