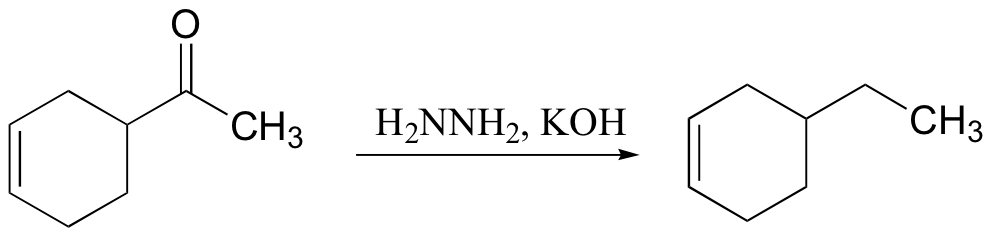Pembentukan dan Sifat-sifat Asam Karboksilat
Karakteristik kimia utama dari asam karboksilat adalah keasamannya. Mereka umumnya lebih asam daripada senyawa organik lain yang mengandung gugus hidroksil tetapi umumnya lebih lemah dari asam mineral seperti HCl. Senyawa di mana ―OH dari gugus karboksil diganti dengan gugus tertentu lainnya disebut turunan asam karboksilat, yang terpenting di antaranya adalah asil halida, anhidrida asam, ester dan amida
adapun sifat sifat fisik asam karboksilat adalah
1. keasaman
Sesuai dengan namanya sifat dari asam karboksilat adalah asam, asam merupakan pemyumbang H+ yang baik. Asam karboksilat adalah salah satu penyumbang asam terbaik oleh karena itu asam karboksilat adalah asam kuat walaupun lebih lemah dari pada asam mineral seperti HCl.
2. Kelarutan
Kelarutan asam karboksilat di dalam air mirip dengan kelarutan dari alkohol. Namun tidak semua asam karboksilat dapat larut di dalam air, hanya asam karboksilat yang memiliki atom c dibawah 5 yang mudah larut di dalam air.
3. Titik didih
Titik didih asam karboksilat lebih tinggi dari pada hidrokarbon, alkohol, eter, aldehida, atau keton dengan berat molekul serupa. Bahkan asam karboksilat yang paling sederhana,asam format, mendidih pada suhu 101 ° C yang jauh lebih tinggi dari titik didih etanol yang mendidih pada 78,5 ° C , meskipun keduanya memiliki berat molekul yang hampir mirip. Untuk mendidih asam karboksilat di butuhkan suhu panas yang tinggi agar pasangan elektron yang berbentuk gas tidak memiliki berat molekul yang ganda dan juga saat pasangan elektron rusak dalam keadaan mendidih, tidak di perlukan tambahan energi untuk memutus ikatan hidrogen.
4. Bau
Bau yang di timbulkan oleh asam karboksilat kebanyakan tidak sedap contohnya bau yang berada di dalam loker terdapat asam karboksilat dan juga keringat.
adapun sifat sifat kimia asam karboksilat adalah
1. Reaksi dengan basa menghasilkan garam dan air
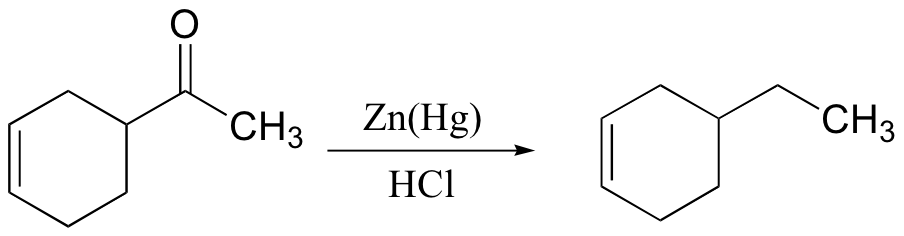
2. Reaksi reduksi dapat menghasilkan aldehid dan atau alkohol primer
3. Reaksi esterifikasi menghasilkan ester dengan di gunakan reaksi kesetimbangan
4. Reaksi dekarbolasi dengan suhu tinggi menghasilkan alkana
Asam karboksilat dapat dibuat dengan beberapa cara, di antaranya
a) Dengan mengoksidasi alkohol primer